Magnetische Ionenbeeinflussung in Wasser zur Reduktion von Kalkablagerungen
Bevor ich mit den Ausführungen beginne, möchte ich eines klarstellen: Die konträren Meinungen zu dieser Wasserbehandlungstechnik sind mir bekannt. Auch dass von wissenschaftlicher Seite diese
Wassertechnik meist als funktionslos abgeschrieben wird, kann ich nachvollziehen. Die oftmals abstrusen Funktionsangaben, verbunden mit geringer oder gar keiner Wirksamkeit, bestärken diese
Meinung noch zusätzlich.
Ich möchte betonen, dass ich keine Geräte vertreibe, keiner Firma angehöre die solche Geräte vertreibt und auch sonst kein geschäftliches Interesse an einer Vermarktung
solcher Geräte habe. Mir geht es lediglich darum, meine These zur Funktion dieser Technik als Diskussionsgrundlage zu veröffentlichen. Dabei möchte ich betonen, dass mit ein paar Magneten oder
sogar nur einem Magnetfeld meiner Meinung nach nichts erreicht wird. Eine ausreichende Funktion kann nur erreicht werden, wenn die eingesetzten Gerätemagnete bezüglich Feldstärken, Anordnungen
und Feldlinienausrichtungen dem Wasserdurchfluss optimal angepasst sind. Wie und warum das meiner Meinung nach so ist, werde ich später erläutern. Aber soviel vorweg: Kein “magnetisches
Wasserbehandlungsgerät” ist in der Lage, seine Funktion optimal zu erfüllen. Die dazu erforderliche Gerätelänge wäre aus praktischen Erwägungen nicht wirtschaftlich. Aufgrund der erforderlichen
Gerätelänge, der Magnetanzahl und den sonstigen Einbauten wäre ein Gerät so teuer, dass es niemand erwerben würde. Eine ausreichende Funktion kann aber auch mit einfacheren, aber gut
durchdachten Magnetanordnungen erzielt werden.
Einführung:
 Korallen, vor Milliarden Jahren in den Ur-Meeren unseres Planeten gewachsen, bestehen vorwiegend aus einem Mineral, das in häuslichen
Wasser-und Heizungsrohren nicht gerne gesehen wird. Der Chemiker nennt es Calziumcarbonat. Obwohl es sich praktisch nur in saurem Wasser
löst, ist es in mehr oder weniger großen Mengen in unserem Trinkwasser vorhanden. Das kommt daher, dass natürliches Niederschlagswasser in
Verbindung mit Kohlendioxid eine schwache Säure bildet, die imstande ist, das schwerlösliche Calziumcarbonat zu lösen. Dabei entsteht das sehr
gut wasserlösliche Calziumhydrogencarbonat. Das Problem besteht nun darin, dass ein Gas, nämlich Kohlenstoffdioxid, mit in die chemische
Reaktion eingebunden ist. Nach dessen Entfernung entsteht wieder das schwerlösliche Calziumcarbonat, das dann die anfangs erwähnten
Probleme verursacht.
In Wasser mit vorwiegend neutralen pH- Werten, wie bei Trinkwasser, kann sich Calziumcarbonat nur in äußerst geringen Mengen lösen. Es wird immer behauptet, dass Calziumcarbonat - zusammen mit
Kohlenstoffdioxid - in der Natur - sich sehr gut und schnell in Wasser lösen wird, aber das ist ein Trugschluss. Ich habe versucht, diese Löslichkeit nachzuahmen. Sie können es auch einmal versuchen:
Man nimmt ein Becherglas und füllt genau einen Liter destilliertes Wasser ein. Anschließend wiegt man genau 178 mg reines Calziumcarbonat in feiner Pulverform ab und rührt es ins Wasser ein. Da das
Calziumcarbonat - wie schon erwähnt - sehr schwerlöslich ist, entsteht eine milchige Suspension, die solange bestehen bleibt, bis das Mineral vollkommen gelöst ist. Danach muss das Wasser vollkommen
klar sein. Die eingewogene Menge Calziumcarbonat entspricht einer Gesamthärte von 10° dH. Nun schließt man eine Kohlenstoffdioxidflasche mit einem Druckminderer an, verbindet einen Schlauch mit
einem Aquarienausströmer und leitet das Kohlendioxid über den Ausströmer in das Wasser ein. Nun muss man nur warten, bis das Wasser klar ist. Dann hat man eine Lösung mit genau 10° dH.
Seltsamerweise ist das Wasser nach 24 Stunden immer noch trüb. Nach 2 Tagen ist es trotz der großen Menge zugeführten Kohlenstoffdioxids auch noch trüb. Ich habe dann abgebrochen weil meine
Kohlenstoffdioxidflasche leer war. Aber der Versuch zeigt eindeutig die Schwerlöslichkeit des Calziumkarbonates. Das kommt daher, dass von dem einströmenden Gas nur ein winziger Bruchteil mit
Wasser Kohlensäure bildet, der Rest blubbert praktisch als Gasblasen aus.
Aufgrund dieser Schwerlöslichkeit ist nachzuvollziehen, warum einmal gebildete Calziumkarbonat - Minikristalle in einem Wasser mit einem pH- Wert um 7,0 oder höher, stabil bleiben und kaum
mehr in Lösung gehen. Löslichkeiten von Calciumcarbonat 14 mg pro Liter Wasser bei 20°C und von Calciumsulfat ( Gips ) > 2000 mg pro Liter Wasser.
Kalkproblematik
Korallen, vor Milliarden Jahren in den Ur-Meeren unseres Planeten gewachsen, bestehen vorwiegend aus einem Mineral, das in häuslichen
Wasser-und Heizungsrohren nicht gerne gesehen wird. Der Chemiker nennt es Calziumcarbonat. Obwohl es sich praktisch nur in saurem Wasser
löst, ist es in mehr oder weniger großen Mengen in unserem Trinkwasser vorhanden. Das kommt daher, dass natürliches Niederschlagswasser in
Verbindung mit Kohlendioxid eine schwache Säure bildet, die imstande ist, das schwerlösliche Calziumcarbonat zu lösen. Dabei entsteht das sehr
gut wasserlösliche Calziumhydrogencarbonat. Das Problem besteht nun darin, dass ein Gas, nämlich Kohlenstoffdioxid, mit in die chemische
Reaktion eingebunden ist. Nach dessen Entfernung entsteht wieder das schwerlösliche Calziumcarbonat, das dann die anfangs erwähnten
Probleme verursacht.
In Wasser mit vorwiegend neutralen pH- Werten, wie bei Trinkwasser, kann sich Calziumcarbonat nur in äußerst geringen Mengen lösen. Es wird immer behauptet, dass Calziumcarbonat - zusammen mit
Kohlenstoffdioxid - in der Natur - sich sehr gut und schnell in Wasser lösen wird, aber das ist ein Trugschluss. Ich habe versucht, diese Löslichkeit nachzuahmen. Sie können es auch einmal versuchen:
Man nimmt ein Becherglas und füllt genau einen Liter destilliertes Wasser ein. Anschließend wiegt man genau 178 mg reines Calziumcarbonat in feiner Pulverform ab und rührt es ins Wasser ein. Da das
Calziumcarbonat - wie schon erwähnt - sehr schwerlöslich ist, entsteht eine milchige Suspension, die solange bestehen bleibt, bis das Mineral vollkommen gelöst ist. Danach muss das Wasser vollkommen
klar sein. Die eingewogene Menge Calziumcarbonat entspricht einer Gesamthärte von 10° dH. Nun schließt man eine Kohlenstoffdioxidflasche mit einem Druckminderer an, verbindet einen Schlauch mit
einem Aquarienausströmer und leitet das Kohlendioxid über den Ausströmer in das Wasser ein. Nun muss man nur warten, bis das Wasser klar ist. Dann hat man eine Lösung mit genau 10° dH.
Seltsamerweise ist das Wasser nach 24 Stunden immer noch trüb. Nach 2 Tagen ist es trotz der großen Menge zugeführten Kohlenstoffdioxids auch noch trüb. Ich habe dann abgebrochen weil meine
Kohlenstoffdioxidflasche leer war. Aber der Versuch zeigt eindeutig die Schwerlöslichkeit des Calziumkarbonates. Das kommt daher, dass von dem einströmenden Gas nur ein winziger Bruchteil mit
Wasser Kohlensäure bildet, der Rest blubbert praktisch als Gasblasen aus.
Aufgrund dieser Schwerlöslichkeit ist nachzuvollziehen, warum einmal gebildete Calziumkarbonat - Minikristalle in einem Wasser mit einem pH- Wert um 7,0 oder höher, stabil bleiben und kaum
mehr in Lösung gehen. Löslichkeiten von Calciumcarbonat 14 mg pro Liter Wasser bei 20°C und von Calciumsulfat ( Gips ) > 2000 mg pro Liter Wasser.
Kalkproblematik

 Kunststoffleitung
Stahlleitung verzinkt
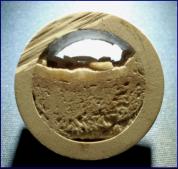
Diese vergleichende Darstellung zeigt
eine natürlich gewachsene Hirnkoralle,
auf der ich ein ähnliches Gebilde aus
Calciumcarbonat aufgesetzt habe, das
in einem Heißwasserboiler aufgewachsen
ist. Man sieht an der grünlichen Farbe,
dass die Installation vorwiegend aus
Kupfer besteht.
Die Probleme in häuslichen Wasserleitungen aufgrund rekristallisierendem Calciumcarbonat zeigen die beiden Fotos mit Rohrschnitten an
einer Kunststoffleitung und einer verzinkten Stahlleitung. Beide Leitungen sind zugewachsen, der Wasserfluss ist stark eingeschränkt.
( Leitungsinfarkt ) Die gezeigten Leitungen stammen aus Gegenden mit sehr hartem und stark kalkabscheidendem Wasser. Bei Ihnen zu Hause
kann es natürlich vollkommen anders sein. Denn Wasser kann sehr hohe Härtegrade aufweisen ohne dass es zu Kalkabscheidungen kommt.
Wenn allerdings Hydrogencarbonat - Ionen neben Calcium - Ionen in ausreichender Konzentration und bestimmtem pH - Werten vorliegen, ist
die Wahrscheinlichkeit hoch, dass es zu harten Abscheidungen kommt. Wären neben Ca - Ionen ausschließlich Sulfat - Ionen vorhanden,
bräuchte man sich z.B. um Härteausscheidungen wenig Gedanken zu machen. Denn die Löslichkeit von Calciumsulfat ist über 100 mal
besser als die von Calciumcarbonat.
Deshalb sollte man genau prüfen, ob beim eigenen Wasser eine Anlage zur Enthärtung oder Härtebeeinflussung überhaupt notwendig ist.
Kalkabscheidungen kommen immer dann vor, wenn das Wasser in irgendeiner Weise eine Veränderung erfährt z.B. Druckänderung und/oder
Erhitzung.
Also immer dann, wenn gebundenes Kohlendioxid entfernt wird.
2 HCO3 minus CO2 = CO3 2- + H2O Die CO32- - Ionen reagieren dann mit den vorhandenen Calcium - Ionen
reaktionsschnell zu Calciumcarbonat.
CO32- + Ca 2+
Kunststoffleitung
Stahlleitung verzinkt
Diese vergleichende Darstellung zeigt
eine natürlich gewachsene Hirnkoralle,
auf der ich ein ähnliches Gebilde aus
Calciumcarbonat aufgesetzt habe, das
in einem Heißwasserboiler aufgewachsen
ist. Man sieht an der grünlichen Farbe,
dass die Installation vorwiegend aus
Kupfer besteht.
Die Probleme in häuslichen Wasserleitungen aufgrund rekristallisierendem Calciumcarbonat zeigen die beiden Fotos mit Rohrschnitten an
einer Kunststoffleitung und einer verzinkten Stahlleitung. Beide Leitungen sind zugewachsen, der Wasserfluss ist stark eingeschränkt.
( Leitungsinfarkt ) Die gezeigten Leitungen stammen aus Gegenden mit sehr hartem und stark kalkabscheidendem Wasser. Bei Ihnen zu Hause
kann es natürlich vollkommen anders sein. Denn Wasser kann sehr hohe Härtegrade aufweisen ohne dass es zu Kalkabscheidungen kommt.
Wenn allerdings Hydrogencarbonat - Ionen neben Calcium - Ionen in ausreichender Konzentration und bestimmtem pH - Werten vorliegen, ist
die Wahrscheinlichkeit hoch, dass es zu harten Abscheidungen kommt. Wären neben Ca - Ionen ausschließlich Sulfat - Ionen vorhanden,
bräuchte man sich z.B. um Härteausscheidungen wenig Gedanken zu machen. Denn die Löslichkeit von Calciumsulfat ist über 100 mal
besser als die von Calciumcarbonat.
Deshalb sollte man genau prüfen, ob beim eigenen Wasser eine Anlage zur Enthärtung oder Härtebeeinflussung überhaupt notwendig ist.
Kalkabscheidungen kommen immer dann vor, wenn das Wasser in irgendeiner Weise eine Veränderung erfährt z.B. Druckänderung und/oder
Erhitzung.
Also immer dann, wenn gebundenes Kohlendioxid entfernt wird.
2 HCO3 minus CO2 = CO3 2- + H2O Die CO32- - Ionen reagieren dann mit den vorhandenen Calcium - Ionen
reaktionsschnell zu Calciumcarbonat.
CO32- + Ca 2+
 CaCO3
= Steinbildung
CaCO3
= Steinbildung
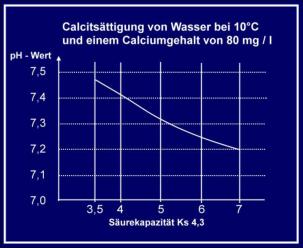 Dieses Diagramm zeigt z.B. bei welchem pH- Wert Wasser von 10° C mit einer
Ca - Konzentration von 80 mg calcitabscheidend ist. Liegt der gemessene pH-
Wert oberhalb der eingetragenen Linie, ist mit Kalkabscheidungen zu rechnen.
Seite 2 : Lösungsreaktion und Lorentz-Kraft
Seite 3 : Elektronenverschiebung im Magnetfeld
Berechnungen mit Video
Seite 4 : Ablenkung und Donatorreaktion im
Magnetfeld
Seite 5 : Erfahrungen mit Geräten
Seite 6 : Praktische Erfahrungen
Seite 7 : Beweisführung zu meiner These
Carbonat + Calcium
Dieses Diagramm zeigt z.B. bei welchem pH- Wert Wasser von 10° C mit einer
Ca - Konzentration von 80 mg calcitabscheidend ist. Liegt der gemessene pH-
Wert oberhalb der eingetragenen Linie, ist mit Kalkabscheidungen zu rechnen.
Seite 2 : Lösungsreaktion und Lorentz-Kraft
Seite 3 : Elektronenverschiebung im Magnetfeld
Berechnungen mit Video
Seite 4 : Ablenkung und Donatorreaktion im
Magnetfeld
Seite 5 : Erfahrungen mit Geräten
Seite 6 : Praktische Erfahrungen
Seite 7 : Beweisführung zu meiner These
Carbonat + Calcium
 Calciumcarbonat
Korallengehäuse
aus Kalkstein
Calciumcarbonat
Korallengehäuse
aus Kalkstein
 Korallen, vor Milliarden Jahren in den Ur-Meeren unseres Planeten gewachsen, bestehen vorwiegend aus einem Mineral, das in häuslichen
Wasser-und Heizungsrohren nicht gerne gesehen wird. Der Chemiker nennt es Calziumcarbonat. Obwohl es sich praktisch nur in saurem Wasser
löst, ist es in mehr oder weniger großen Mengen in unserem Trinkwasser vorhanden. Das kommt daher, dass natürliches Niederschlagswasser in
Verbindung mit Kohlendioxid eine schwache Säure bildet, die imstande ist, das schwerlösliche Calziumcarbonat zu lösen. Dabei entsteht das sehr
gut wasserlösliche Calziumhydrogencarbonat. Das Problem besteht nun darin, dass ein Gas, nämlich Kohlenstoffdioxid, mit in die chemische
Reaktion eingebunden ist. Nach dessen Entfernung entsteht wieder das schwerlösliche Calziumcarbonat, das dann die anfangs erwähnten
Probleme verursacht.
In Wasser mit vorwiegend neutralen pH- Werten, wie bei Trinkwasser, kann sich Calziumcarbonat nur in äußerst geringen Mengen lösen. Es wird immer behauptet, dass Calziumcarbonat - zusammen mit
Kohlenstoffdioxid - in der Natur - sich sehr gut und schnell in Wasser lösen wird, aber das ist ein Trugschluss. Ich habe versucht, diese Löslichkeit nachzuahmen. Sie können es auch einmal versuchen:
Man nimmt ein Becherglas und füllt genau einen Liter destilliertes Wasser ein. Anschließend wiegt man genau 178 mg reines Calziumcarbonat in feiner Pulverform ab und rührt es ins Wasser ein. Da das
Calziumcarbonat - wie schon erwähnt - sehr schwerlöslich ist, entsteht eine milchige Suspension, die solange bestehen bleibt, bis das Mineral vollkommen gelöst ist. Danach muss das Wasser vollkommen
klar sein. Die eingewogene Menge Calziumcarbonat entspricht einer Gesamthärte von 10° dH. Nun schließt man eine Kohlenstoffdioxidflasche mit einem Druckminderer an, verbindet einen Schlauch mit
einem Aquarienausströmer und leitet das Kohlendioxid über den Ausströmer in das Wasser ein. Nun muss man nur warten, bis das Wasser klar ist. Dann hat man eine Lösung mit genau 10° dH.
Seltsamerweise ist das Wasser nach 24 Stunden immer noch trüb. Nach 2 Tagen ist es trotz der großen Menge zugeführten Kohlenstoffdioxids auch noch trüb. Ich habe dann abgebrochen weil meine
Kohlenstoffdioxidflasche leer war. Aber der Versuch zeigt eindeutig die Schwerlöslichkeit des Calziumkarbonates. Das kommt daher, dass von dem einströmenden Gas nur ein winziger Bruchteil mit
Wasser Kohlensäure bildet, der Rest blubbert praktisch als Gasblasen aus.
Aufgrund dieser Schwerlöslichkeit ist nachzuvollziehen, warum einmal gebildete Calziumkarbonat - Minikristalle in einem Wasser mit einem pH- Wert um 7,0 oder höher, stabil bleiben und kaum
mehr in Lösung gehen. Löslichkeiten von Calciumcarbonat 14 mg pro Liter Wasser bei 20°C und von Calciumsulfat ( Gips ) > 2000 mg pro Liter Wasser.
Kalkproblematik
Korallen, vor Milliarden Jahren in den Ur-Meeren unseres Planeten gewachsen, bestehen vorwiegend aus einem Mineral, das in häuslichen
Wasser-und Heizungsrohren nicht gerne gesehen wird. Der Chemiker nennt es Calziumcarbonat. Obwohl es sich praktisch nur in saurem Wasser
löst, ist es in mehr oder weniger großen Mengen in unserem Trinkwasser vorhanden. Das kommt daher, dass natürliches Niederschlagswasser in
Verbindung mit Kohlendioxid eine schwache Säure bildet, die imstande ist, das schwerlösliche Calziumcarbonat zu lösen. Dabei entsteht das sehr
gut wasserlösliche Calziumhydrogencarbonat. Das Problem besteht nun darin, dass ein Gas, nämlich Kohlenstoffdioxid, mit in die chemische
Reaktion eingebunden ist. Nach dessen Entfernung entsteht wieder das schwerlösliche Calziumcarbonat, das dann die anfangs erwähnten
Probleme verursacht.
In Wasser mit vorwiegend neutralen pH- Werten, wie bei Trinkwasser, kann sich Calziumcarbonat nur in äußerst geringen Mengen lösen. Es wird immer behauptet, dass Calziumcarbonat - zusammen mit
Kohlenstoffdioxid - in der Natur - sich sehr gut und schnell in Wasser lösen wird, aber das ist ein Trugschluss. Ich habe versucht, diese Löslichkeit nachzuahmen. Sie können es auch einmal versuchen:
Man nimmt ein Becherglas und füllt genau einen Liter destilliertes Wasser ein. Anschließend wiegt man genau 178 mg reines Calziumcarbonat in feiner Pulverform ab und rührt es ins Wasser ein. Da das
Calziumcarbonat - wie schon erwähnt - sehr schwerlöslich ist, entsteht eine milchige Suspension, die solange bestehen bleibt, bis das Mineral vollkommen gelöst ist. Danach muss das Wasser vollkommen
klar sein. Die eingewogene Menge Calziumcarbonat entspricht einer Gesamthärte von 10° dH. Nun schließt man eine Kohlenstoffdioxidflasche mit einem Druckminderer an, verbindet einen Schlauch mit
einem Aquarienausströmer und leitet das Kohlendioxid über den Ausströmer in das Wasser ein. Nun muss man nur warten, bis das Wasser klar ist. Dann hat man eine Lösung mit genau 10° dH.
Seltsamerweise ist das Wasser nach 24 Stunden immer noch trüb. Nach 2 Tagen ist es trotz der großen Menge zugeführten Kohlenstoffdioxids auch noch trüb. Ich habe dann abgebrochen weil meine
Kohlenstoffdioxidflasche leer war. Aber der Versuch zeigt eindeutig die Schwerlöslichkeit des Calziumkarbonates. Das kommt daher, dass von dem einströmenden Gas nur ein winziger Bruchteil mit
Wasser Kohlensäure bildet, der Rest blubbert praktisch als Gasblasen aus.
Aufgrund dieser Schwerlöslichkeit ist nachzuvollziehen, warum einmal gebildete Calziumkarbonat - Minikristalle in einem Wasser mit einem pH- Wert um 7,0 oder höher, stabil bleiben und kaum
mehr in Lösung gehen. Löslichkeiten von Calciumcarbonat 14 mg pro Liter Wasser bei 20°C und von Calciumsulfat ( Gips ) > 2000 mg pro Liter Wasser.
Kalkproblematik


 Kunststoffleitung
Stahlleitung verzinkt
Diese vergleichende Darstellung zeigt
eine natürlich gewachsene Hirnkoralle,
auf der ich ein ähnliches Gebilde aus
Calciumcarbonat aufgesetzt habe, das
in einem Heißwasserboiler aufgewachsen
ist. Man sieht an der grünlichen Farbe,
dass die Installation vorwiegend aus
Kupfer besteht.
Die Probleme in häuslichen Wasserleitungen aufgrund rekristallisierendem Calciumcarbonat zeigen die beiden Fotos mit Rohrschnitten an
einer Kunststoffleitung und einer verzinkten Stahlleitung. Beide Leitungen sind zugewachsen, der Wasserfluss ist stark eingeschränkt.
( Leitungsinfarkt ) Die gezeigten Leitungen stammen aus Gegenden mit sehr hartem und stark kalkabscheidendem Wasser. Bei Ihnen zu Hause
kann es natürlich vollkommen anders sein. Denn Wasser kann sehr hohe Härtegrade aufweisen ohne dass es zu Kalkabscheidungen kommt.
Wenn allerdings Hydrogencarbonat - Ionen neben Calcium - Ionen in ausreichender Konzentration und bestimmtem pH - Werten vorliegen, ist
die Wahrscheinlichkeit hoch, dass es zu harten Abscheidungen kommt. Wären neben Ca - Ionen ausschließlich Sulfat - Ionen vorhanden,
bräuchte man sich z.B. um Härteausscheidungen wenig Gedanken zu machen. Denn die Löslichkeit von Calciumsulfat ist über 100 mal
besser als die von Calciumcarbonat.
Deshalb sollte man genau prüfen, ob beim eigenen Wasser eine Anlage zur Enthärtung oder Härtebeeinflussung überhaupt notwendig ist.
Kalkabscheidungen kommen immer dann vor, wenn das Wasser in irgendeiner Weise eine Veränderung erfährt z.B. Druckänderung und/oder
Erhitzung.
Also immer dann, wenn gebundenes Kohlendioxid entfernt wird.
2 HCO3 minus CO2 = CO3 2- + H2O Die CO32- - Ionen reagieren dann mit den vorhandenen Calcium - Ionen
reaktionsschnell zu Calciumcarbonat.
CO32- + Ca 2+
Kunststoffleitung
Stahlleitung verzinkt
Diese vergleichende Darstellung zeigt
eine natürlich gewachsene Hirnkoralle,
auf der ich ein ähnliches Gebilde aus
Calciumcarbonat aufgesetzt habe, das
in einem Heißwasserboiler aufgewachsen
ist. Man sieht an der grünlichen Farbe,
dass die Installation vorwiegend aus
Kupfer besteht.
Die Probleme in häuslichen Wasserleitungen aufgrund rekristallisierendem Calciumcarbonat zeigen die beiden Fotos mit Rohrschnitten an
einer Kunststoffleitung und einer verzinkten Stahlleitung. Beide Leitungen sind zugewachsen, der Wasserfluss ist stark eingeschränkt.
( Leitungsinfarkt ) Die gezeigten Leitungen stammen aus Gegenden mit sehr hartem und stark kalkabscheidendem Wasser. Bei Ihnen zu Hause
kann es natürlich vollkommen anders sein. Denn Wasser kann sehr hohe Härtegrade aufweisen ohne dass es zu Kalkabscheidungen kommt.
Wenn allerdings Hydrogencarbonat - Ionen neben Calcium - Ionen in ausreichender Konzentration und bestimmtem pH - Werten vorliegen, ist
die Wahrscheinlichkeit hoch, dass es zu harten Abscheidungen kommt. Wären neben Ca - Ionen ausschließlich Sulfat - Ionen vorhanden,
bräuchte man sich z.B. um Härteausscheidungen wenig Gedanken zu machen. Denn die Löslichkeit von Calciumsulfat ist über 100 mal
besser als die von Calciumcarbonat.
Deshalb sollte man genau prüfen, ob beim eigenen Wasser eine Anlage zur Enthärtung oder Härtebeeinflussung überhaupt notwendig ist.
Kalkabscheidungen kommen immer dann vor, wenn das Wasser in irgendeiner Weise eine Veränderung erfährt z.B. Druckänderung und/oder
Erhitzung.
Also immer dann, wenn gebundenes Kohlendioxid entfernt wird.
2 HCO3 minus CO2 = CO3 2- + H2O Die CO32- - Ionen reagieren dann mit den vorhandenen Calcium - Ionen
reaktionsschnell zu Calciumcarbonat.
CO32- + Ca 2+
 CaCO3
= Steinbildung
CaCO3
= Steinbildung
 Dieses Diagramm zeigt z.B. bei welchem pH- Wert Wasser von 10° C mit einer
Ca - Konzentration von 80 mg calcitabscheidend ist. Liegt der gemessene pH-
Wert oberhalb der eingetragenen Linie, ist mit Kalkabscheidungen zu rechnen.
Seite 2 : Lösungsreaktion und Lorentz-Kraft
Seite 3 : Elektronenverschiebung im Magnetfeld
Berechnungen mit Video
Seite 4 : Ablenkung und Donatorreaktion im
Magnetfeld
Seite 5 : Erfahrungen mit Geräten
Seite 6 : Praktische Erfahrungen
Seite 7 : Beweisführung zu meiner These
Carbonat + Calcium
Dieses Diagramm zeigt z.B. bei welchem pH- Wert Wasser von 10° C mit einer
Ca - Konzentration von 80 mg calcitabscheidend ist. Liegt der gemessene pH-
Wert oberhalb der eingetragenen Linie, ist mit Kalkabscheidungen zu rechnen.
Seite 2 : Lösungsreaktion und Lorentz-Kraft
Seite 3 : Elektronenverschiebung im Magnetfeld
Berechnungen mit Video
Seite 4 : Ablenkung und Donatorreaktion im
Magnetfeld
Seite 5 : Erfahrungen mit Geräten
Seite 6 : Praktische Erfahrungen
Seite 7 : Beweisführung zu meiner These
Carbonat + Calcium
 Calciumcarbonat
Korallengehäuse
aus Kalkstein
Calciumcarbonat
Korallengehäuse
aus Kalkstein